醫療器材開發的關鍵風險
深入理解並有效緩解開發過程中的各類風險,縮短您的開發時程並確保最終成功
作者:Travis Schneider Aerotech 業務開發經理
醫療創新是一件令人振奮的事,想到一項新的療法、裝置或產品能夠改善生活品質或拯救生命,總是讓人充滿激情,這點誰不贊同呢?因此,醫療技術應用經常在新創公司的概念中名列前茅,隨著全球人口不斷老化,世界各地對於醫療解決方案、技術進步以及更高效、更易於取得的醫療器材與服務的需求也日益增加。
然而,在現代開發醫療器材的過程,可能如同在雷區中航行,醫療器材的開發具有其內在風險,涵蓋技術、法規與臨床等多個面向,要緩解這些風險,需要在整個產品生命週期中進行細緻的規劃、嚴格的測試與警覺的風險管理,以確保對患者和醫療服務提供者的安全性與有效性,考量到這些眾多關鍵因素,醫療器材的開發比以往任何時候都更加複雜。
因此,醫療器材製造商需要全面應對開發新裝置時伴隨的諸多風險,本篇文章將重點說明醫療器材製造商在開發初期以及整個產品生命週期中,需要考量的各項關鍵因素。
分類的角色
醫療產品的開發並非從設計開始,在開發流程的早期階段,有許多面向需要預先考量,包括可製造性設計、測試、驗證與確效,審視這些階段所需的嚴謹程度,通常取決於所開發醫療器材的類型或等級。
醫療器材的分類,是根據確保其安全與有效性所需的監管控制級別而定,雖然不同國家或地區的分類系統可能略有不同,但由美國食品藥物管理局 (FDA, U.S. Food and Drug Administration) 建立的系統是普遍採用的標準,歐洲聯盟將醫療器材分為四類(Class I、Class IIa、Class IIb 和 Class III),而 FDA 則將其分為三個主要等級 [1]:
第一級醫療器材 (Class I Medical Devices)
- 屬於低至中度風險的器材。
- 設計簡單,通常不會對患者構成重大風險。
- 範例包括繃帶、檢查手套和一些手持式手術器械。
- 通常受到最少的法規管制。
第二級醫療器材 (Class II Medical Devices)
- 屬於中至高度風險的器材。
- 相較於第一級器材更為複雜,其使用可能伴隨著較高的風險。
- 範例包括電動輪椅、輸液泵和某些診斷設備。
- 受到更嚴格的法規管制,包括特殊的標籤要求與上市後監督 (post-market surveillance)。
第三級醫療器材 (Class III Medical Devices)
- 屬於高度風險的器材。
- 通常用於維持或支持生命、可能導致疾病或傷害的重大風險,或是目前尚無同等器材的創新產品。
- 範例包括植入式心律調節器、心臟瓣膜和一些先進的診斷影像設備。
- 受到最高級別的法規管制,包括上市前核准 (pre-market approval)。
這些分類有助於監管機構在器材的審批過程中,決定適當的監督級別,這也確保了醫療器材在市場銷售或應用於醫療場域前,能符合特定的安全與性能標準。
需求開發與管理
需求開發與管理可能是開發新型醫療器材中,最為重要的一個環節,這是一個關鍵流程,涉及在整個開發生命週期中定義、記錄與控制醫療器材的規格及特性,這些需求為器材的設計、製造與確效奠定了基礎,從而確保其符合預期用途和法規標準。
對需求開發與管理的審慎關注,對於交付安全、有效且高品質的醫療器材至關重要,若未能嚴謹地開發、完善與追蹤需求,開發人員很可能將新產品推向失敗的境地,這個過程可能耗時,甚至對設計團隊而言相當痛苦,但省略此一步驟將使他們面臨多重法規、商業與技術挑戰。
以下是需求開發與管理流程中的一些關鍵要素:
需求探索
此為初始階段,由終端使用者、臨床醫生、法規專家與工程師等利害關係人共同參與,以識別醫療器材的需求與期望,這包括進行訪談、工作坊與調查,以收集寶貴的意見,重要的是,必須了解此新裝置將解決的普遍性問題,並定義其將為患者帶來的最佳結果,在進行這些訪談時,應避免對潛在的終端使用者產生偏見,因為開發人員往往會自然地傾向於展示解決方案,而非發掘真正未被滿足的需求。
需求文件化
一旦需求被識別出來,就需要系統性地將其文件化,適當的文件化可確保清晰性、可追溯性並與法規保持一致,需求文件可能包括使用者需求規格、設計輸入需求與功能規格,需求文件化過程也應涉及多種角色,以確保建立正確的制衡機制,產品或行銷經理通常以較不技術性的方式記錄需求,工程團隊則將這些需求轉化為開發團隊可以依循的、更為詳細或技術性的需求,行銷與工程團隊必須保持溝通,確保這種轉化能夠在正確的脈絡下,精確地捕捉使用者需求。
確效與驗證
需求必須經過驗證,且使用者需求必須獲得確效,以確保其準確、完整並與器材的預期用途保持一致,確效 (Validation) 確保器材符合其預期目的,而驗證 (Verification) 則檢查器材設計是否符合指定的規格要求。
可追溯性管理
可追溯性是指將需求與設計、驗證及確效活動連結起來的能力,一個如表 1 所示的穩健需求追溯矩陣,有助於確保每個需求在開發過程中都得到處理,並為提交法規文件提供基礎,在整個開發過程中維持此追溯矩陣,將在產品上市的後期階段節省大量的時間與精力。
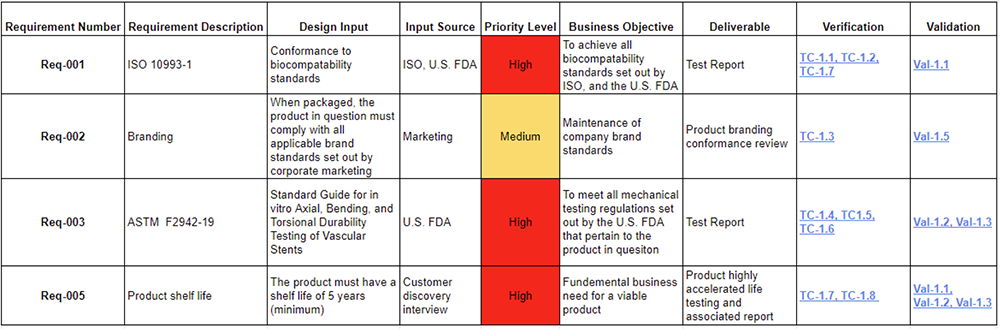
表 1:需求追溯矩陣範例。
變更控制
在器材的開發生命週期中,需求可能會因為新的見解、回饋或法規更新而發生變化,變更控制流程可確保所有變更都得到管理、評估其影響並被妥善記錄,以維持器材開發的完整性。
風險管理
識別與管理醫療器材的風險及潛在危害,對於減輕相關風險並確保患者安全至關重要,風險登錄表是一項重要工具,能幫助設計團隊在整個開發過程中管理風險,並提供一種更具分析性的方法,以便在開發早期階段處理最高風險的元素,對於沒有標準風險登錄表或希望改進現行方法的開發人員,此範本 [2] 將會非常有用。
法規遵循
醫療器材的需求必須與相關的法規、標準及指導方針保持一致,例如由 FDA、ISO 13485 和歐洲醫療器材法規 (European Medical Device Regulation) 所設定的標準,證明符合這些法規對於取得監管批准至關重要。
使用者回饋迴路
與利害關係人、終端使用者及其他相關方建立一個回饋迴路,有助於根據真實世界的使用經驗與不斷變化的需求,來完善與更新需求,這對於產品的技術優化與商業驗證至關重要。
需求驗證測試
作為設計驗證過程的一部分,醫療器材製造商必須執行測試,以證明器材符合其規定的需求,驗證測試確認器材能如預期般運作,並符合適用的標準。
設計控管
妥善管理需求是整體設計控管 (design controls) 流程中不可或缺的一部分,此流程確保以系統化的方法開發醫療器材,使其能滿足使用者需求與法規要求。
有效的需求開發與管理在成功將醫療器材推向市場、促進患者安全以及提升整體產品質量與性能方面,扮演著關鍵角色,這是一個在器材的整個生命週期中持續進行的迭代過程,不良的需求管理將導致重大的專案延遲,並增加對患者造成重大風險的可能性,甚至可能引發產品召回與訴訟,通常,一個強大的專案管理辦公室將透過在整個開發過程中提供架構、監督與有效溝通,來支持並引導需求管理。
對於選擇外包或與第三方合作開發器材的製造商而言,這些面向尤其重要,合作夥伴組織對於嚴謹的需求開發有深刻的理解,並了解這些需求如何相互關聯,這通常是至關重要的,理想的合作夥伴組織應能反映醫療器材原始設備製造商的能力、對產業有深入的了解、配備專職的專案管理團隊,並維持其自身的品質管理系統 (QMS, Quality Management System),他們應當理解需求的重要性,並能將其正確地轉化為必要的執行範疇。
法規風險
醫療器材開發中的法規遵循風險,係指在特定市場中,與取得主管機關(例如美國的 FDA)的適當監管批准,以及遵循適用法律、法規與標準相關的挑戰及不確定性,將醫療器材推向市場的過程,涉及在一個複雜且不斷演變的法規環境中航行,若未能充分應對這些風險,可能導致時程延誤、成本增加,甚至無法將器材上市。
其中一個關鍵風險是分類風險,正確判斷器材的法規等級至關重要,因為錯誤的分類可能導致選擇了不正確的提交途徑或提交了不足的佐證資料。
此外,法規環境持續變動,因此醫療器材公司必須隨時掌握頻繁的法規更新與變更,以確保在整個開發過程中持續合規,經驗豐富的法規專業人士已習慣這種環境,並常在規劃時預留應變方案。
除了強大的法規部門外,醫療器材製造商還應配備一個強大的品質部門,透過維持一個穩健的品質管理系統 (QMS) 來協助應對法規遵循,若未能實施有效的 QMS,可能導致在監管稽核中發現不合規項目,這兩個部門通常密切合作,以產出一份設計歷史檔案 (DHF, Design History File),這是一份全面且有組織的彙編文件,記錄了器材的設計與開發歷史,DHF 對於醫療器材製造商而言,是一項關鍵的法規要求,並作為產品在其整個開發生命週期中,設計控管活動與決策過程的永久記錄。
正確的提交程序也同樣關鍵,取得監管批准可能是一個漫長的過程,如果延誤,可能會影響市場進入時機並耗損財務資源,若用以支持安全性與有效性聲明的臨床前或臨床資料不足,可能導致監管機構拒絕提交申請,或要求進行額外的研究,這將進一步延遲批准時程並導致專案成本超支,再者,全球法規框架的差異性,要求企業制定策略性規劃,以應對不同國家進入國際市場的要求。
即使在器材上市後,醫療器材製造商也必須建立有效的上市後監督系統,以監測並報告不良事件與故障,若未能做到這一點,可能導致法規不符與潛在的產品召回,正確的標籤與行銷對於法規遵循也至關重要,誤導性的聲明或不充分的使用說明,可能導致監管處罰並損害公司聲譽,其他上市後的問題也可能源於忽視人為因素與可用性考量,這些問題可能導致使用錯誤與額外的法規稽核發現。
成本風險
成本風險是指可能增加總生產成本的未預見開支的潛在可能性,管理成本風險對於醫療器材製造商確保盈利能力、財務穩定性與市場競爭力至關重要。
有幾個關鍵因素會導致醫療器材製造中的成本風險,首先是材料成本,包括原料與零組件,這些成本可能因市場狀況變化、供應鏈中斷或地緣政治因素而波動,對特定供應商的依賴引入了供應鏈風險,供應商的中斷、延遲或品質問題,都可能導致成本增加或生產延誤,關鍵材料的價格突然上漲或短缺,會顯著影響製造成本,近年來,製造商還必須應對通貨膨脹或經濟衰退期等經濟變化對製造成本的影響。
勞動成本在製造成本中也扮演著關鍵角色,薪資、福利與培訓費用會因地點和市場條件而異,勞動成本、勞動力可用性或勞動法規的變化,都可能影響整體製造成本,自動化與機器人技術通常可用於輔助或管理勞動成本,但對於第三級產品,通常仍需要一定程度的人工介入。
最後,法規遵循本身就是一個重要的成本驅動因素,醫療器材製造商必須在研究、測試、文件記錄與認證方面進行投資,以符合必要的標準,這也增加了整體製造成本,同樣地,品質控制與測試是成本風險的另一個重要面向,維持一個穩健的品質控制流程,並投資於精密的測試設備與技術熟練的人員,以確保器材的安全性與有效性,會增加製造成本。
為有效管理成本風險,醫療器材製造商必須進行全面的成本分析、制定應急計畫,並在供應鏈與製造流程中保持彈性,採納精實製造實務與持續改進的措施,有助於在確保高品質產品與符合法規要求的同時,優化成本,此外,與供應商的密切合作,以及採取主動的方法來識別和應對成本驅動因素,可以緩解成本風險,並增強醫療器材製造業務的整體財務健全性。
時程風險
考量到醫療技術產業的競爭格局,上市速度至關重要,產品開發時程的延誤或中斷,可能影響器材上市的既定計畫、相應的營收預測以及商業案例分析,如果醫療器材製造商要滿足法規截止日期、市場需求與財務目標,管理時程風險是必不可少的。
在此情況下,擁有一個強大的專案管理團隊來處理產品上市的複雜時程,也是理想的選擇,如圖 1 所示,一個範例時程通常充滿了相互依賴性與無法加速的門控因素(例如,法規提交、生物相容性測試、加速壽命測試等),若無周詳的監督與規劃,專案團隊可能會在某些關鍵進度項目進行期間,經歷延誤或資源利用率受限的時期。
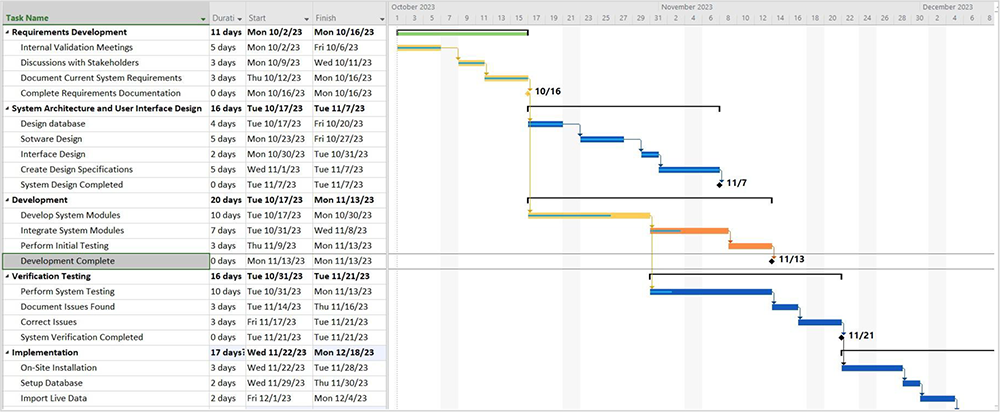
圖 2:甘特圖範例。
許多項目都可能影響時程,前述提及的範例包括法規提交、供應商延誤、測試與確效,在開發後期,技術範疇與需求的變更也可能對計畫造成重大阻礙,因為這些變更可能使許多已完成的任務失效。
為有效管理醫療器材製造中的時程風險,公司應採用主動的專案管理實務,例如以下幾點:
- 制定一份包含明確里程碑與截止日期的詳細專案計畫。
- 在開發過程的早期階段識別潛在風險,並制定應急計畫,特別是針對風險最高的元素。
- 定期監控進度,並根據需要調整時程,以應對任何延誤或突發問題。
- 在所有利害關係人之間保持開放的溝通,以確保共識一致並迅速解決任何障礙。
- 尋求專家建議,並利用過去專案的經驗來預測與緩解潛在的時程風險。
透過採取主動且具適應性的方法來管理時程風險,醫療器材製造商可以提高達成專案時程的可能性,並成功地按時將安全有效的產品推向市場。
關於作者

Travis Schneider 是 Aerotech 公司負責先進製造市場區隔的業務開發經理,涵蓋的領域包括電子製造、雷射加工、醫療技術、資料儲存與精密製造,他在精密自動化與機器人領域擁有超過 13 年的經驗,曾擔任應用工程、現場銷售、產品管理與業務開發等職位,他曾與多家領先的醫療儀器製造商、醫療器材 OEM 廠商及手術機器人公司合作,共同開發並將產品推向市場。
Travis 於密爾瓦基工程學院取得機械工程學士學位,他的專業知識與對創新的熱情,使他成為合作夥伴在推動先進製造精密自動化領域中,尋求突破的寶貴資源。
參考資料
[1] “Classify Your Medical Device,” U.S. Food & Drug Administration, February 7, 2020,
https://www.fda.gov/medical-devices/overview-device-regulation/classify-your-medical-device.
[2] “Risk Register Template,” Leading Agile, 2023,
https://www.leadingagile.com/wp-content/uploads/2015/05/Risk-Register-Sample.xlsx.
相關產品
下列產品是實現高精度醫療器材製造的核心硬體與系統,涵蓋從基礎運動控制到專用微加工解決方案:
- LaserTurn®160 圓柱形雷射加工平台:
專為心導管、支架等管狀工件設計的整合式雷射加工系統,是精密管材加工的理想選擇。 - AGV5D 五軸雷射微加工進動掃描器:
針對複雜3D曲面與微結構的雷射加工,適用於製造醫療植入物或微流體晶片。 - 運動控制龍門:
提供大範圍、高精度的運動平台,常用於從金屬管材或平板上進行心臟支架的雷射切割。 - 五軸空氣軸承系統:
提供極致的定位精度與平滑運動,適用於對表面光潔度與尺寸公差有嚴苛要求的醫療光學元件或模具製造。 - 史都華六軸平台 (Hexapods):
以六個自由度進行複雜的空間定位與姿態調整,是醫療器材精密組立、光纖對位或產品測試的關鍵設備。 - 運動控制平台 (Automation1):
驅動上述所有精密運動的核心,整合伺服、振鏡與先進控制演算法,是確保加工品質與穩定性的基礎。
延伸閱讀
以下技術文章深入探討了在高精度醫療器材製造中,用以克服技術挑戰、提升產能與品質的關鍵控制技術:
- 圓柱工件雷射光柵掃描技術:結合位置同步輸出與飛行標刻之高速加工策略:
深入解析如何在心導管等管狀工件上實現高速、均勻的雷射加工。 - IFOV 與 PSO 技術:突破雙光子聚合 (2PP) 積層製造的品質與產能瓶頸:
探討如何運用先進運動控制,在微米等級的3D列印(如生物支架、微針)中實現突破。 - DrillOptimizer | 消除雷射鑽孔步進穩定延遲,實現零秒瞬定加工:
此技術可大幅提升在導管或過濾膜上進行微孔陣列加工的效率與精度。 - 高精度五軸雷射進動掃描技術(PSO) 如何提升微加工能力:
專門探討如何利用五軸掃描技術,在複雜形狀的植入物上製造出高品質的微結構。 - 進階雷射控制技術:IFOV、PSO 與功率校正,實現高精度一致性加工:
整合說明了確保雷射能量在工件上精確、一致分佈的多項核心技術,是保證醫療器材品質的關鍵。 - 精密雷射加工機實現高產出率的基礎概念:
從系統設計角度闡述如何打造一台能同時滿足高精度與高產能需求的醫療器材製造設備。
